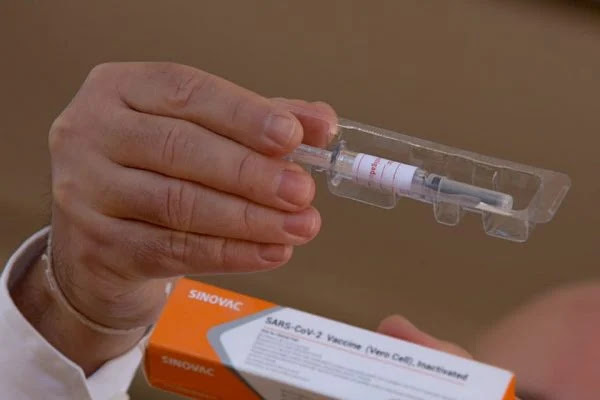
No centro da polêmica envolvendo o presidente Jair Bolsonaro e o governador de São Paulo, João Doria (PSDB-SP), a Sinovac — empresa chinesa à frente da produção de uma das possíveis vacinas contra a Covid-19 em fase de testes no território brasileiro — recebeu, em julho, duas certificações da Agência Nacional de Vigilância Sanitária (Anvisa) atestando Boas Práticas de Fabricação de Medicamentos.
Em publicação no Diário Oficial da União do dia 1º de julho, o laboratório ganhou da agência o certificado por conta dos “insumos farmacêuticos de ativos biológicos para a vacina adsorvida Hepatite A (inativada)”. Oito dias depois, o segundo foi concedido pelas soluções parenterais de pequeno volume com preparação asséptica.
O Certificado de Boas Práticas de Fabricação (CBPF), segundo o próprio site da Anvisa, é um documento que atesta a qualidade do processo de produção e o cumprimento da legislação em vigor no Brasil. A agência verifica se as condições de fabricação seguem as normas em todas as suas etapas. O documento emitido para as requerentes vale para aquele determinado local e indica a condição de manufaturar produtos com qualidade, de forma estável.
Em nota, a Anvisa respondeu que a certificação é um pré-requisito para fabricantes que almejam submeter processos de registro no Brasil. “A CBPF trata das condições de uma linha específica de produção para atender os requisitos necessários para fabricar um produto. Os certificados publicados referem-se a outros locais de fabricação e não estão relacionados à produção de vacina da Covid-19. O processo de certificação da Sinovac com foco na linha de produção de vacina da Covid-19 ainda está em andamento”, disse a nota.
A Gerência-Geral de Inspeção e Fiscalização Sanitária da Anvisa ressaltou que a certificação citada pertence a estabelecimento fabril distinto, localizado em endereço diferente, que nada tem a ver com o processo da Vacina Coronavac. “Não é possível correlacionar ou estender as boas práticas de uma planta produtiva de um medicamento para outro local de fabricação, ainda que seja do mesmo medicamento.”
Vacina Coronavac
A Anvisa vem acompanhando de perto todo o processo de testagem da vacina contra a Covid-19 desenvolvida pela Sinovac. A agência autorizou o Instituto Butantan a iniciar testes no Brasil em 3 de julho deste ano. A imunização, que apresentou bons resultados para a produção de anticorpos em etapas anteriores de ensaios clínicos, está realizando a fase 3 da pesquisa no país.
No início de outubro, a agência recebeu o primeiro pacote de dados referente aos testes da farmacêutica chinesa. A revisão desses números, possível devido à implantação do procedimento de submissão contínua, permite aos técnicos verificarem os documentos à medida que se tornam disponíveis. Isso não significa, porém, um pedido oficial de registro da vacina, mas facilita o processo, caso o governo decida comprar o produto.
Metrópoles
Coronavírus